
Проф. Павленко А. В., директор Института Стоматологии Национальной Медицинской Академии Последипломного Образования им. П.Л.Шупика.
Д-р Проць Г. Б., доцент кафедры хирургической стоматологии Ивано-Франковского Государственного Национального Медицинского Университета.
Д-р Баранов А. Б. — врач-стоматолог-ортопед, г. Краснодар.
Dr. Shterenberg А., к.м.н., B.Sc. Ph.D., лектор-консультант компании Sunstar Guidor, Zurich, Switzerland.
Сохранение костной ткани, создание адекватного объема и регенерация кости — по-прежнему самые актуальные темы хирургической стоматологии, имплантологии и парадонтологии. Для того чтобы осуществить все эти мероприятия, используется огромное разнообразие различных костных и кость замещающих материалов. Однако все больше и больше появляется в литературе публикаций, указывающих на то, что очень много врачей имплантологов, перестали увлекаться собственной костью, как материалом для восстановления утраченной костной ткани, в целях применения дентальной имплантации.
Забор собственной кости у пациента — это всегда вторая операция, которая не безразлична для пациента. Через полгода при раскрытии операционного поля, как правило, остается половина подложенного материала.
Мы не будем в данной статье повторяться в рассказах о всех, применяемых сегодня в стоматологии остеотропных материалах. Хотя, обратим Ваше внимание на то, что в последние годы, все большую популярность приобретают материалы синтетического происхождения. Особенно материалы, которые имеют такие свойства, как технологичность, биосовместимость, высокая пористость, резорбируемость, способность выступать в роли матрицы при регенерации костной ткани. Чтобы быть уверенным, что предполагаемое лечение будет, как можно менее травматичным, все чаще и чаще стали применяться костьзамещающие материалы, на основе β-ТКФ, такие как easy-graft и easy-graft CRYSTAL.
Основное назначение костьзамещающих материалов, это выступать в роли платформы. Они способствуют регенерации костной ткани, которая начинается от костной стенки дефекта и распространяется через материал к центру дефекта (Lu Z et al. 2010). Человеческая костная ткань, в большей части своего неорганического состава содержит (около 70%) модифицированный гидроксиапатит, который состоит, прежде всего из Ca² (кальций) и PO¾ (фосфат). Использование синтетических фосфатов кальция, как заменителей кости рассматривалось очень давно, из-за химической композиции, очень подобной структуре костной ткани.
Первый документ клинического применения кальций-фосфатных соединений датирован в 1920 г. Фосфаты кальция использовались, как костьзамещающие материалы в хирургической стоматологии почти до конца 1970 года (Le Geros et al.2003).
Сегодня, синтетические кальций фосфаты очень широко применяются, как костьзамещающие материалы, для заполнения различных костных дефектов в повседневной клинической практике.Чаще всего применяются такие варианты:
— Монофазный костьзамещающий материал β-три кальций фосфат (β-ТКФ; Ca3(PO4)2.
— Гидроксиапатиты — НА Ca10(PO4)6(OH)2.
— Бифазный кальций фосфат (БКФ) – представляющий из себя соединение β-ТКФ и НА.
Все три материала в большинстве своем содержат кальций и фосфат, в различных пропорциональных соотношениях.β-TКФ, HA и БКФ отличаются друг от друга только степенью резорбции, где самый высокий уровень принадлежит β-TКФ, а самый низкий — НА. Однако резорбируемость материала не зависит исключительно от типа кальций фосфата. Многие другие факторы, такие как пористость, технологичность, влияют на уровень резорбции.
Easy-graft содержит чистую фазу β–TКФ и подтвержден как монофазный материал, полностью резорбируемый в течении нескольких месяцев (Nair et al. 2006; Rothamel et al. 2007; Glaser 2009).
Easy-graft CRYSTAL — это бифазный материал и состоит из 60% НА и 40% β–TКФ. Он резорбируется частично и сохраняет НА, окруженный вновь сформированной костной тканью, на более длительный период.
Пористость костьзамещающего материала, является ключевым фактором в регенерации костной ткани.
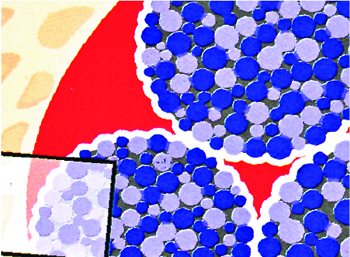
Макропористость материала — это наличие пространства между круглыми, устойчивыми к давлению гранулами, что создает благоприятные условия для формирования новой кости и развитию ангиогенеза, необходимого для обеспечения питания новых тканей и выведения продуктов метаболизма. Однако следует помнить, что гранулы должны быть достаточно прочными, чтобы во время применения этих материалов не наступала их фрагментация или раскалывание. (Рис.1)
Высокая микропористость кальций фосфатов (размер пор от 1 до 10µм) увеличивает остеокондуктивные свойства материала, а так же увеличивает регенерацию новой кости по сравнению с материалами, не обладающими микропористостью (Habibovic et al.2005: Hing et al. 2005; Habibovic et al.2006) (Рис.2).
Общеизвестный факт, что поры являются своеобразными нишами для остеогенных клеток, поэтому материалы с открытыми пористыми системами очень привлекательны для факторов роста. Особенно таких важных для регенерации костной ткани факторов, как PDGF–факторы, стимулирующие остеобласты и VTGF–факторы, стимулирующие образование эндотелия сосудов.
Вновь сформированная костная ткань, обнаруженная в микропорах, подтверждает тот факт, что процесс интеграции кальций фосфата происходит на микропористом уровне (Lan Levengood et al. 2010). Еasy-graft CRYSTAL — открытая микропористые структура.

Рис. 1 Макропористость материала
easy-graft CRYSTAL

Рис. 2 Микропористость гранулы
easy-graft CRYSTAL
В этой статье мы расскажем о втором поколении остеотропных материалов, на основе β-три кальций фосфата, того же производителя. Это материал — easy-graft CRYSTAL.
Easy-graft CRYSTAL состоит из бифазного кальций фосфата БКФ в композиции 60% искусственного гидроксиапатита и 40% β-ТКФ. При производстве easy-graft CRYSTAL не просто производится смешивание двух материалов, а создается истинное новое соединений НА и β-ТКФ. Это означает, что каждая гранула материала easy-graft CRYSTAL состоит из двух материалов.
Бифазный кальций фосфат пришел в хирургическую стоматологию из ортопедии (Passuti et al. 1989; Delecrin et al. 2000; Xie et al. 2006);
Он используется при операции синус лифта с одномоментной установкой имплантатов (Cordaro et al. 2008; Froum et al. 2008; Lee et al. 2008); при заполнении костных карманов (Sculean et al. 2008); при дефектах после удаления кисты (Piattelli et al. 1996); для заполнения лунки удаленного корня зуба (Weiss et al. 2007).

easy-graft CRYSTAL
каждая гранула состоит из
соединения 60% НА ■ 40% β – ТКФ ■
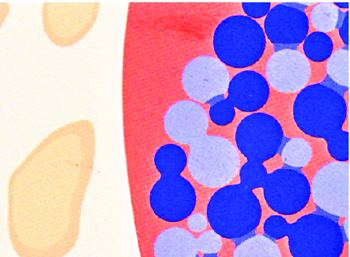
easy-graft CRYSTAL при
контакте с кровью твердеет ■
Резорбируется оболочка ПЛГК
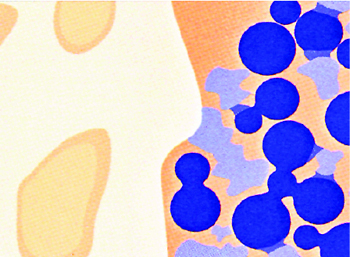
Начинает резорбироваться β – ТКФ
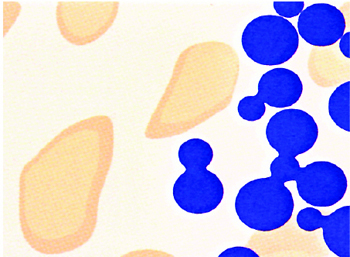
НА замурован во вновь сформированную кость
Входящий в состав би-фазного материала β-ТКФ (40%) полностью резорбируется, путем растворения в межтканевой жидкости, не последнюю роль играет и клеточный механизм (Lan Evengood et al 2010 ). Искусственный гидроксиапатит (60%) остается в дефекте на более долгое время и продолжает выполнять роль остеокондуктивной матрицы. Это может быть рассмотрено, как преимущество данной методики, особенно при больших дефектах, например киста, как процесс замедленной регенерации. Конечный результат процесса заживления — это соединение новой собственной кости и НА. Интегрированный НА может обеспечивать профилактику атрофии и сохранять объем твердых тканей более длительное время (Zafiropoulos et al. 2007).
Применение материала easy-graft CRYSTAL при узком гребне альвеолярного отростка в боковом отделе нижней челюсти.
Реабилитация стоматологических больных, методом дентальной имплантации при узком гребне альвеолярного отростка нижней челюсти, является довольно частой проблемой дентальной имплантации.
Много различных хирургических методик по увеличению объема костной ткани атрофированного отростка нижней челюсти, описаны в литературе. Предлагаемые стратегии решения этой проблемы включают в себя использование блоков собственной кости (21-23), применение методики направленной костной регенерации (24-26), расщепление альвеолярного отростка (27) и дистракционный остеогенез (28).
Технология расширения или расщепления узкого гребня альвеолярного отростка нижней челюсти сводится к созданию ложа под имплантаты путем горизонтального рассечения альвеолярной кости (29) по центру отростка и создания двух послабляющих вертикальных рассечений, для перемещения вестибулярной кортикальной пластинки в щечную сторону. Пространство между вестибулярной и язычной кортикальными пластинками, а так же между имплантатами, заполняется остеотропным материалом (24-27).
Данная методика всегда предусматривает одновременную установку имплантатов и в значительной степени сокращает сроки лечения пациентов.
В представленном исследовании демонстрируется клиническое использование материала easy-graft CRYSTAL для заполнения костного дефекта после расщепления узкого альвеолярного отростка нижней челюсти с одновременной установкой имплантатов.После проведения местной инфильтрационной анестезии Sol. Septanest с эпинефрином 1/100 000 — 1,7 ml был произведен разрез мягких тканей по центру альвеолярного отростка. Длина горизонтального разреза зависит от количества устанавливаемых имплантатов и расстояния между имплантатами. Были так же произведены два вертикальных разреза по вестибулярной поверхности альвеолярного отростка. Был отслоен полный слизисто-надкостничный лоскут, открывающий вестибулярную стенку отростка. С язычной стороны лоскут несколько смещался в сторону полости рта и целиком не откидывался, для обеспечения хорошего кровоснабжения кости и сохранения его прикрепления.
Горизонтальная кортикотомия производилась с помощью циркулярной пилы из набора инструментов для расщепления альвеолярного отростка немецкой компании Meisinger и начиналась с отступом 1-2 мм от зуба, ограничивающего дефект зубного ряда.
Два послабляющих вертикальных распила вестибулярной кортикальной пластинки осуществлялись с помощью алмазного конусовидного бора. Длина проведенных распилов была равна, примерно, половине длины предполагаемых для установки имплантатов. Однако глубина распилов осуществлялась на всю толщину кортикальной пластики.
Перемещение вестибулярной кортикальной пластинки проводилось с помощью дистракторов и спредеров из этого же набора инструментов. После создания финишным сверлом ложа, имплантаты были установлены.
После снятия дистракторов, промежуток между пластинками и имплантатами был заполнен материалом easy-graft CRYSTAL. При контакте с кровью материал твердел и хорошо удерживал дефект. Слизисто-надкостничный лоскут был уложен на свое место, и рана ушита нерассасывающимся шовным материалом.
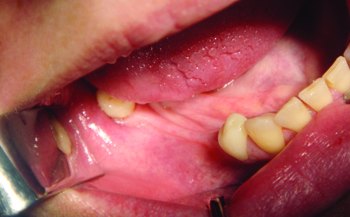
Рис. 1 Исходная ситуация
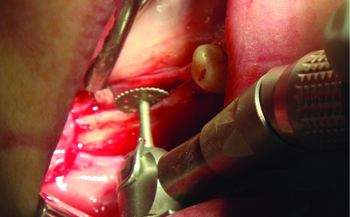
Рис. 2 Горизонтальный распил
альвеолярного отростка
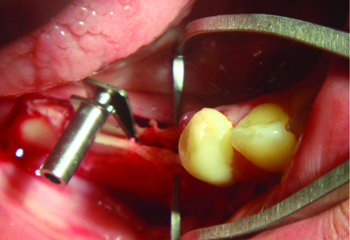
Рис. 3 Расщепление отростка
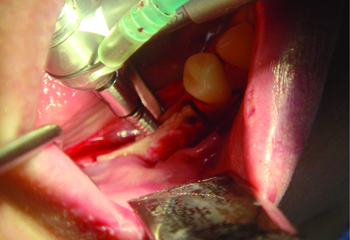
Рис. 4 Обозначение места
установки имплантатов
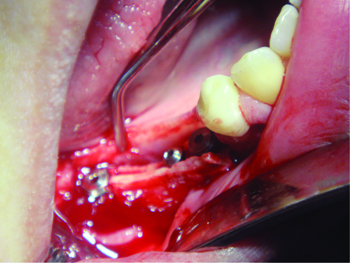
Рис. 5 Установлены имплантаты

Рис. 6 PRGF и мембрана
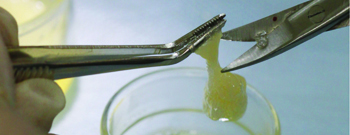
Рис. 7 Забор порции плазмы

Рис. 8 Фибриновая мембрана
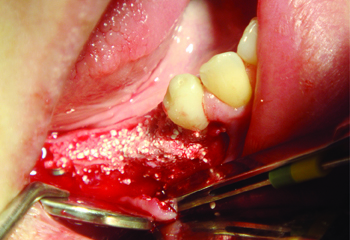
Рис. 9 Дефект заполнен
материалом easy-graft CRYSTAL
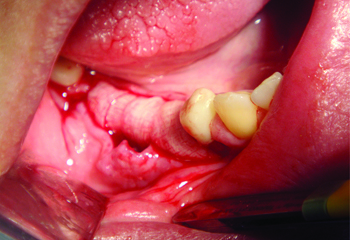
Рис. 10 Мембрана уложена
на раневую поверхность
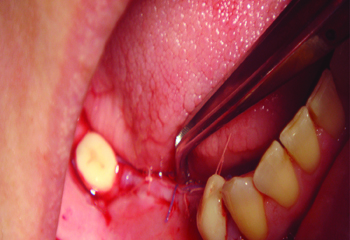
Рис. 11 Рана ушита
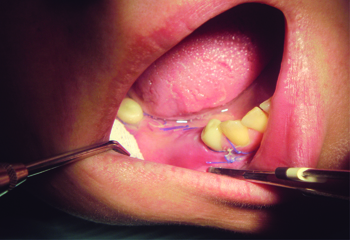
Рис. 12 На 10 день после операции
В настоящем исследовании при выполнении операции по расщеплению альвеолярного отростка нижней челюсти, в качестве наполнителя промежутка между кортикальными пластинками и имплантатами, использовался бифазный материал easy-graft CRYSTAL.
Твердеющий в дефекте материал обеспечивал стабильность вестибулярной кортикальной пластинки и кровяного сгустка.Чем больше размер дефекта, тем больше объем кости должен быть сформирован и соответственно требуется больше времени на процесс заживления.Материал easy-graft CRYSTAL показан для использования при больших дефектах по двум соображениям. Первое — материал обладает высокой остеокондуктивностью, которая способствует формированию костных мостиков в дефекте. Второе — гидроксиапатит, в данной композиции выступает как остеокондуктивная платформа, даже при увеличивающемся процессе заживления и регенерации.
В данном клиническом случае, материал easy-graft CRYSTAL укладывался в виде «наполеона» то есть послойно с плазмой, богатой факторами роста. Для этой цели из собственной крови больного была получена плазма богатая факторами роста (PRGF) и фибриновая мембрана, которая была уложена поверх материала и имплантатов.
1. Cordaro L, Bosshardt D. D., Pala-ttella P., Rao W., Serino G. and Chiapasco M.: Maxillary sinus grafting with Bio-Oss or Strau-mann Bone Ceramic: histomor-phometric results from a randomized controlled multicenter clinical trial Clin Oral Implants Res (2008) 19(8): 796-803.
2. Delecrin J., Takahashi S., Gouin F. and Passuti N.: A synthetic porous ceramic as a bone graft substitute in the surgical management of scoliosis: a prospective, randomized study Spine (2000) 25(5): 563-9.
3. Froum S. J., Wallace S. S., Cho S. C, Elian N. and Tarnow D. P.: Histomorphometric comparison of a biphasic bone ceramic to anorganic bovine bone for sinus augmentation: 6- to 8-month postsur-gical assessment of vital bone formation. A pilot study Int J Peri-odontics Restorative Dent (2008) 28(3): 273-81.
4. Glaser R.: Rehabilitation mit 3D-Planung und Kieferkammerhalt Zahn Arzt (2009) 29-31.
5. Habibovic P., Yuan H., van der Valk C. M., Meijer G., van Blitterswijk C. A. and de Groot K.: 3D microenvironment as essential element for osteoinduction by biomaterials Biomaterials (2005) 26(17): 3565-75.
6. Habibovic P., Sees T. M., van den Doel M. A., van Blitterswijk C. A. and de Groot K.: Osteoinduction by biomaterials - physicochemical and structural influences J Biomed Mater Res A (2006) 77(4): 747-62.
7. Hing K. A., Annaz B., Saeed S., Revell P. A. and Buckland T: Microporosity enhances bioactivity of synthetic bone graft substitutes J Mater Sci Mater Med (2005) 16(5): 467-75.
8. Lan Levengood S. K., Polak S. J., Wheeler M. B., Maki A. J., Clark S. Jamison R. D. and Wagoner Johnson A. J Multiscale osteointegration as a new paradigm for the design of calcium phosphate scaffolds for bone regeneration. Biomaterials (2010)
9. Lee J. H., Jung U. W., Kim C. S., Choi S. H. and Cho K. S.: Histologic and clinical evaluation for maxillary sinus augmentation using macroporous biphasic calcium phosphate in human Clin Oral Implants Res (2008) 19(8): 767-71.
10. LeGeros R. Z. and LeGeros J. P.: Calcium Phosphate Bioceramics: Past, Present and Future Key Engineering Materials (2003) 240-242: 3-10.
11. Lu Z. and Zreiqat H.: The Osteo-conductivity of Biomaterials Is Regulated by Bone Morphogenetic Protein 2 Autocrine Loop Involving alpha beta Integrin and Mitogen-Activated Protein Kinase/Extracellular Related Kinase Signaling Pathways Tissue Eng Part A (2010)
12. Nair P. N., Luder H. U., Maspe-ro F. A., Fischer J. H. and Schug J.: Biocompatibility of Beta-tricalcium phosphate root replicas in porcine tooth extraction sockets - a correlative histological, ultrastructural, and X-ray microanalytical pilot study J Biomater Appl (2006) 20(4): 307-24.
13. Passuti N., Daculsi G., Rogez J. M., Martin S. and Bainvel J. V.: Macroporous calcium phosphate ceramic performance in human spine fusion Clin Orthop Relat Res (1989) (248): 169-76.
14. Piattelli M., Favero G. A., Scarano A., Orsini G. and Piattelli A.: Bone reactions to anorganic bovine bone (Bio-Oss) used in sinus augmentation procedures: a histologic long-term report of 20 cases in humans Int J Oral Maxillofac Implants (1999) 14(6): 835-40.
15. Rothamel D., Schwarz F, Herten M., Chiriac G., Pakravan N., Sager M. and Becker J.: [Dimensional ridge alterations following tooth extraction. An experimental study in the dog] Mund Kiefer Gesicht-schir (2007) 11(2): 89-97.
16. Sculean A., Windisch P., Szendroi-Kiss D., Horvath A., Rosta P., Becker J., Gera I. and Schwarz, R: Clinical and histologic evaluation of an enamel matrix derivative combined with a biphasic calcium phosphate for the treatment of human intrabony periodontal defects J Periodontol (2008) 79(10): 1991-9.
17. Weiss P., Layrolle P., Clergeau L. P., Enckel B., Pilet P., Amouriq Y, Daculsi G. and Giumelli B.: The safety and efficacy of an injectable bone substitute in dental sockets demonstrated in a human clinical trial Biomaterials (2007) 28(22): 3295-305.
18. Xie Y, Chopin D., Morin C, Hardouin P., Zhu Z., Tang J. and Lu J.: Evaluation of the osteogenesis and biode-gradation of porous biphasic ceramic in the human spine Biomaterials (2006)27(13): 2761-7.
19. Zafiropoulos G. G., Hoffmann O., Kasaj A., Willershausen B., Weiss O. and Van Dyke T. E.: Treatment of intrabony defects using guided tissue regeneration and autogenous spongiosa alone or combined with hydroxyapatite/beta-tricalcium phosphate bone substitute or bovine-derived xeno-graft J Periodontol (2007) 78(11): 2216-25.
20. Pikos MA: Block autografts for localized ridge augmentation. part II. The posteriormandible. Implant Dent 9:67, 2000part II. The posterior mandible. Implant Dent 9:67, 2000
21. Cordaro L, Amade DS, Cordaro M: Clinical results of alveolar ridge augmentation with mandibular block bone grafts in par- tially edentulous patients prior to implant placement. Clin Oral Implants Res 13:103, 2002
22. Takahashi T, Funaki K, Shintani H, et al: Use of horizontal alveolar distraction osteogenesis for implant placement in a narrow alveolar ridge: A case report. Int Oral Maxillofac Implants.19:291, 2004
23. Laster Z, Rachmiel A, Jensen OT: Alveolar width distraction osteogenesis for early implant placement. J Oral Maxillofac Surg 63:1724, 2005
24. Enislidis G, Wittwer G, Ewers R: Preliminary report on a staged ridge splitting technique for implant placement in the mandible: A technical note. Int J Oral Maxillofac Implants 21:445,2006.
25. Sohn DS, Ahn MR, Lee WH, et al: Piezoelectric osteotomy for intraoral harvesting of bone blocks. Int J Periodontics Restorative Dent 27:127, 2007
26. Sohn DS: Color Atlas, Clinical Applications of Piezoelectric Bone Surgery. Seoul, Kunja Publishing Group, 2008
27. Sohn DS, An KM, Lee JS, et al: Erbium, chromium:yttriumscandium- gallium-garnet laser-assisted sinus graft procedure. Lasers Med Sci 24:673, 2009
28. Calvo Guirado JL, Pardo Zamora G, Saez Yuguero MR: Ridge splitting technique in atrophic anterior maxilla with immediate implants, bone regeneration and immediate temporization: Acase report. J Ir Dent Assoc 53:187, 2007
29. Elian N, Jalbout Z, Ehrlich B, et al: A two-stage full-arch ridge expansion technique: Review of the literature and clinical guidelines. Implant Dent 17:16, 2008
Статья опубликована в журналах:
1. «Современная Стоматология» №1, 2013 г. стр. 89-92Национальной медицинской академии последипломного образования, Киев, Украина
2. Dental Magazine №9, 2013 г.